Потенциальное лекарство от патологий нервной системы может ускорять распространение болезни
Фермент катепсин D, который ранее рассматривался как потенциальное лекарство для борьбы с медленно прогрессирующими заболеваниями нервной системы, может способствовать распространению патологии, сообщили РИА Новости в Российском научном фонде со ссылкой на учёных Института цитологии РАН.
Накопление в нервной ткани амилоидов — агрегатов неправильно свёрнутых белков — сопутствует развитию нейродегенеративных заболеваний, среди которых болезни Альцгеймера и Паркинсона, муковисцидоз, некоторые типы диабета и наследственной катаракты. Такие агрегаты представляют собой нитевидные структуры — фибриллы, образующие скопления (бляшки).
Эти структуры нарушают передачу сигналов в головном мозге, вызывают гибель нервных клеток и тем самым способствуют развитию деменции и ухудшению моторных функций. Чтобы разработать эффективные и безопасные методы борьбы с этими пока ещё неизлечимыми заболеваниями, нужно понимать механизмы образования и разрушения опасных амилоидных фибрилл.
Как установили учёные, в эти процессы вовлечены ферменты из группы протеаз, в частности катепсин D. Но научные данные о роли катепсина D были противоречивыми: с одной стороны, повышение его уровня связывали со сборкой новых амилоидных скоплений, а значит, прогрессированием заболевания. Другие работы продемонстрировали, что фермент расщепляет один из ключевых белков, способствующих развитию болезни Паркинсона. При этом большинство исследований проводилось на отдельных белковых молекулах, тогда как влияние протеаз на фибриллы и амилоидные кластеры оставалось неизученным.
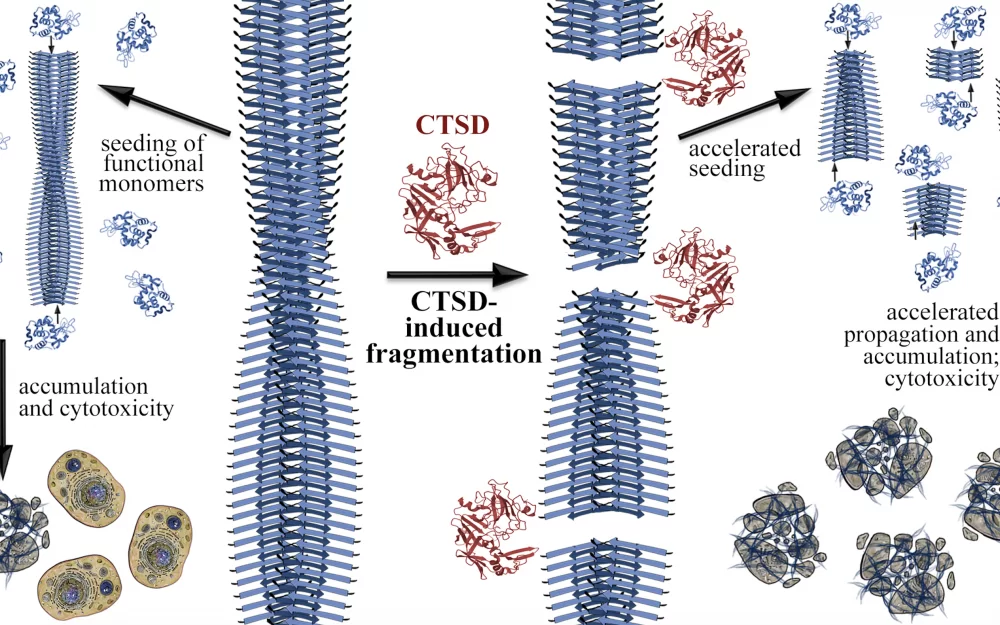
Специалисты из петербургского Института цитологии РАН исследовали, как катепсин D взаимодействует с амилоидными фибриллами, и выяснили, что, разрушая их, он не снижает их токсичность, а может способствовать распространению патологии.
«Наше открытие ценно, поскольку оно помогает лучше понять роль протеаз в образовании амилоидных агрегатов. Так, мы показали, что катепсин D, хотя и разрушает фибриллы, не снижает их цитотоксичность и может способствовать образованию новых амилоидов. Это важно учитывать при разработке стратегий лечения болезней Альцгеймера, Паркинсона и других», — пояснила руководитель проекта, поддержанного грантом РНФ, ведущий научный сотрудник лаборатории структурной динамики, стабильности и фолдинга белков Института цитологии РАН Анна Сулацкая.
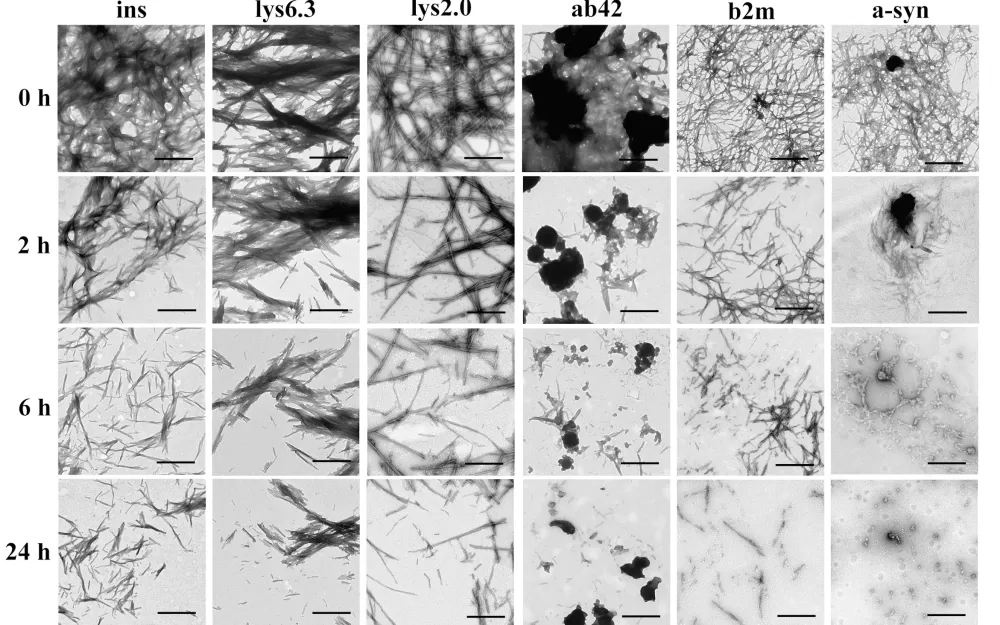
В процессе исследования учёные искусственно синтезировали нитевидные белковые структуры, а затем на время (от двух часов до суток) добавляли к ним катепсин D. Наблюдения показали, что фермент разрушил водородные связи между бета-нитями, из которых сложены амилоидные фибриллы, — это привело к распаду фибрилл на фрагменты.
Затем исследователи проверили, как такое разрушение повлияло на способность амилоидов вредить живым клеткам. Для этого в суспензии разных типов человеческих клеток добавляли как исходные, так и обработанные ферментом фибриллы. Выяснилось, что разрушение амилоидных фибрилл катепсином D не только не снизило их токсичность, но, напротив, ускорило накопление и распространение патологических белков между клетками и тканями.
Дело в том, что фрагментация фибрилл приводит к увеличению количества затравок для формирования новых амилоидных структур, объяснили авторы исследования. Кроме того, небольшие фрагменты фибрилл могут выделяться из одной клетки и поглощаться другой, что способствует распространению патологических форм амилоидов в окружающие ткани и напоминает механизм заражения.
В дальнейшем учёные планируют одновременно фрагментировать амилоиды с помощью катепсина D и разрушать их упорядоченную структуру при посредстве других ферментов. Такой комбинированный подход позволит преодолеть побочные эффекты фрагментации, связанные с увеличением скорости образования фибрилл, и повысит эффективность их разрушения.
Результаты исследования, поддержанного грантом Российского научного фонда, опубликованы в журнале International Journal of Biological Macromolecules.












Написать комментарий